Was genau sind die Prozesse, die aus einer gesunden Leber eine fibrotische Leber machen? Finden sich dort gegebenenfalls Ansatzpunkte für die Therapie von Lebererkrankungen? Um diese Fragen beantworten zu können, haben Wissenschaftler der Klinik für Dermatologie, Venerologie und Allergologie der Universitätsmedizin Mannheim (UMM) die Rolle der Blutgefäße bei der Entstehung der Leberfibrose untersucht. Dabei gewannen sie nicht nur ein besseres Verständnis der der Fibrose zugrundeliegenden Krankheitsprozesse, sondern sehen ebenso die neuere Erkenntnis bestätigt, dass Blutgefäße die Organfunktion kontrollieren können.
Parallel zur steigenden Zahl der Übergewichtigen in Deutschland – laut Adipositas Gesellschaft e.V. zwei Drittel der Männer und die Hälfte der Frauen – hat in den letzten Jahren auch die Häufigkeit der nicht-alkoholischen Fettlebererkrankungen (NAFLD) zugenommen. Sie übersteigt inzwischen deutlich die der durch Alkohol verursachten Fettlebererkrankungen.
Die meist durch ungesunden Lebensstil verursachte „Wohlstandserkrankung“ kann im Verlauf zu einer Leberfibrose führen, bei der durch Umbauprozesse zunehmend Lebergewebe durch Bindegewebe ersetzt wird. Dies geht mit einer verringerten Leberfunktion einher. Schreitet diese Entwicklung fort, kann es zu einer chronischen Leberentzündung (nicht-alkoholische Steatohepatitis, NASH) und bis hin zu einer nicht mehr heilbaren Leberzirrhose oder Leberkrebs kommen.
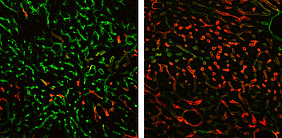
Das Forscherteam der UMM um Professor Dr. Sergij Goerdt, Privatdozent Dr. Philipp Reiners-Koch und Professor Dr. Cyrill Géraud widmet sich speziell den sogenannten Lebersinusoiden, den kleinsten und hoch spezialisierten Blutgefäßen der Leber. In vorangegangenen Arbeiten hatten sie bereits zeigen können, dass der Transkriptionsfaktor GATA4 wichtig für die korrekte Entwicklung dieser Blutgefäße ist.
Transkriptionsfaktoren erkennen bestimmte DNA-Strukturen, binden daran und regulieren so, ob von einem Genabschnitt die Information für ein neues Protein abgelesen wird oder nicht. Wird ein solcher Transkriptionsfaktor in einem Modellsystem ausgeschaltet, können aus möglichen Veränderungen oder Ausfällen Rückschlüsse auf dessen Funktion gezogen werden. In der aktuell veröffentlichen Arbeit, die im angesehenen Fachjournal „Journal of Hepatology“ erschienen ist, konnten die Wissenschaftler zeigen, dass der Verlust von GATA4 in dem die Lebersinusoiden auskleidenden Endothel ausreicht, um eine Leberfibrose zu verursachen, was mit einer gestörten Funktion und Regenerationsfähigkeit des gesamten Organs einhergeht.
Darüber hinaus konnten sie nachweisen, dass spezielle, von Blutgefäßen abgegebene Botenstoffe, sogenannte angiokrine Faktoren, die Fibrose der Leber vermitteln. Dazu gehört beispielsweise der Wachstumsfaktor PDGFB (Platelet-derived growth facor B). Und auch ein Großteil der Genexpression in den Blutgefäßen der Leber ist verändert. Dadurch ändern sich Struktur und Funktion der Lebersinusoide, sodass diese zunehmend Blutgefäßen ähneln, wie sie in anderen Organen, etwa der Lunge, zu finden sind. Diese Beobachtungen wurden sowohl in Modellsystemen der Leberfibrose, als auch bei Patienten mit Leberzirrhose gemacht.
Die vorliegende Arbeit trägt zu einem besseren Verständnis der Krankheitsprozesse bei der Leberfibrose bei. „Dass Funktionsstörungen der Blutgefäße der Leber direkt zu einer gestörten Funktion des gesamten Organs führen, bestätigt, dass die Blutgefäße die Organfunktion – und damit auch Krankheitsprozesse – kontrollieren können“ erklärt Privatdozent Dr. Philipp Reiners-Koch. „Darüber hinaus ist mit der Achse GATA4/PDGFB ein potenzieller neuer Angriffspunkt für eine mögliche Therapie identifiziert worden“ ergänzt Erstautor Dr. Manuel Winkler, auch stellvertretend für seine Co-Erstautoren Theresa Staniczek, Sina Kürschner und Dr. Christian Schmid.
Die wissenschaftliche Arbeit ist im Rahmen des an der Universitätsmedizin Mannheim angesiedelten Sonderforschungsbereichs 1366 „Vaskuläre Kontrolle der Organfunktion“ der Deutschen Forschungsgemeinschaft (DFG) in Kooperation zwischen Arbeitsgruppen des European Center for Angioscience (ECAS) der Medizinischen Fakultät Mannheim der Universität Heidelberg, des Deutschen Krebsforschungszentrums (DKFZ), des Zentrums für Molekulare Biologie der Universität Heidelberg (ZMBH) sowie der Technischen Universität München (TUM) entstanden. Zudem wird Dr. Manuel Winkler durch das von der DFG unterstütze Clinician-Scientist-Programm der Fakultät „Interfaces and Interventions in Complex Chronic Conditions (ICON)“ gefördert.
Publikation
Endothelial GATA4 controls liver fibrosis and regeneration by preventing a pathogenic switch in angiocrine signaling
Winkler M, Staniczek T, Kürschner SW, Schmid CD, Schönhaber H, Cordero, J, Kessler L, Mathes A, Sticht C, Neßling M, Uvarovskii A, Anders S, Zhang Xj, von Figura G, Hartmann, D, Mogler C, Dobreva G, Schledzewski K, Géraud C, Koch PS, Goerdt S.
Journal of Hepatology (2020)
DOI: https://doi.org/10.1016/j.jhep.2020.08.033