Sie befinden sich hier
Inhalt

Herzerkrankungen sind die häufigste Ursache für Todesfälle und stellen die häufigste Krankenhausdiagnose dar. Trotz etablierter, klinisch erfolgreicher pharmakologischer und interventioneller Therapien und einem Rückgang der Mortalitätsrate von Herzkrankheiten in den letzten Jahren sind die pathophysiologischen Mechanismen der Erkrankungen bzw. die Wirkung ihrer medizinischen Behandlung auf der zellulären Ebene des Herzmuskels, spezieller der Kardiomyozyten, nur unzureichend bekannt.
Die Arbeitsgruppe „Cardiomyocytes as basic units of cardiovascular diseases“ untersucht die physiologischen Funktionen und pathologischen Reaktionen humaner Herzmuskelzellen in Modellen unterschiedlicher klinisch manifester Erkrankungszuständen des Herz-Kreislaufsystems. Dabei werden sowohl akute Krankheitszustände (z. B. Myokardinfarkt, Myokarditis) als auch chronische, zu Herzkrankheiten führende Risikofaktoren im Zellkulturmodell an humanen, aus Stammzellen generierten Kardiomyozyten simuliert. Einen wichtigen Baustein der Forschung bildet die Untersuchung der Induktion pro-arrhythmischer Mechanismen durch die unterschiedlichen Modelle. Neben der Analyse der zellulären Reaktionen bildet die Erforschung pharmakologischer Interventionen der Kardiomyozyten-Antwort einen weiteren Aspekt der laufenden Projekte.
Ein Myokardinfarkt (MI) ist ein primär lokales Ereignis, das zur Aktivierung einer akuten systemischen Entzündungsreaktion führt. Dies spiegelt sich in der Erhöhung von Akut-Phase-Proteinen, pro-inflammatorischen Mediatoren, der Rekrutierung inflammatorischer Zellen zum Myokard und der Stammzellmobilisierung wieder.
Auch auf lokaler Ebene des Myokards finden Veränderungen nach einem Myokardinfarkt statt. Wir untersuchten die Oberflächenmoleküle CD54/ICAM1, CD58/LFA-3 und CD321/JAM-A auf aus humanen induzierten Stammzellen (hiPSC) differenzierten Kardiomyozyten (hiPSC-KMs) nach Kontakt mit Serum von MI-Patienten.
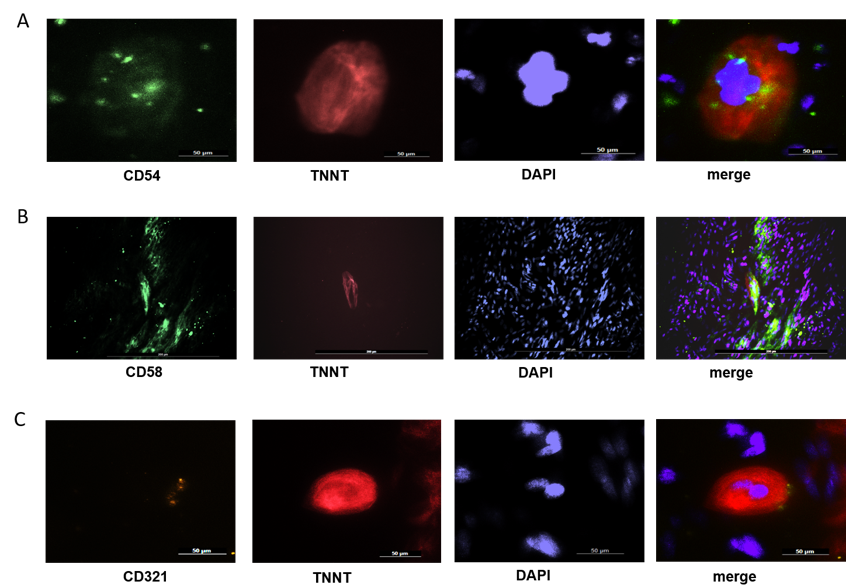
Wir beschrieben erstmalig die stabile Expression der Zelladhäsionsproteine CD54/ICAM-1, CD58/LFA-3 and CD321/JAM-A auf hiPSC-KMs. Abbildung 1 zeigt die Immunfluoreszenzfärbung der Marker auf bzw. in hiPSC-Kardiomyozyten (Troponin T (TNNT)-positive Zellen).
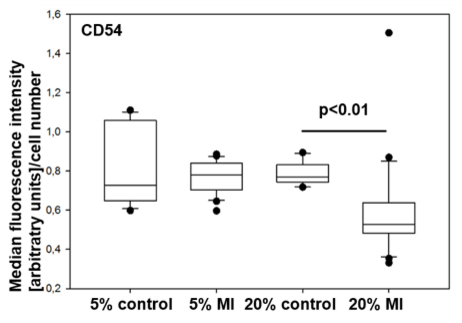
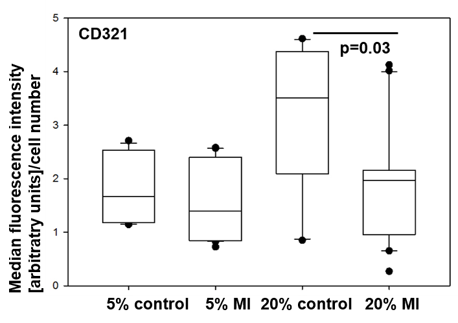
Inkubation der hiPSC-KMs mit Serum von MI-Patienten reduzierte die Oberflächenexpression der Adhäsionsmoleküle CD54/ICAM1 und CD321/JAM-A (Abb. 2).
Der nicht-selektive Kationen-Kanal Transient Receptor Potential Vanilloid 1 (TRPV1) wird durch unterschiedliche chemische und physikalische Stimuli aktiviert. Er bildet ein Homotetramer in der Plasmamembran und shuttelt monovalente und divalente Kationen. TRPV1 vermittelt Hitze- und Schmerzempfinden in unterschiedlichen Organsystemen und ist beteiligt an neurogener Inflammation, Schmerz, Autoimmunerkrankungen und der Glukose-Homöostase.
Im kardiovaskulären System wurde TRPV1 die Beteiligung an unterschiedlichen, teils konträren Vorgängen zugeschrieben: Reperfusionsschaden, vaskuläres Remodelling, arterielle und pulmonale Hypertonie, kardiale ventrikuläre Hypertrophie.
Wir untersuchten die Hypothese, daß TRPV1 an der Lipopolysaccharide (LPS)-induzierten Entzündung von Kardiomyozyten beteiligt ist.
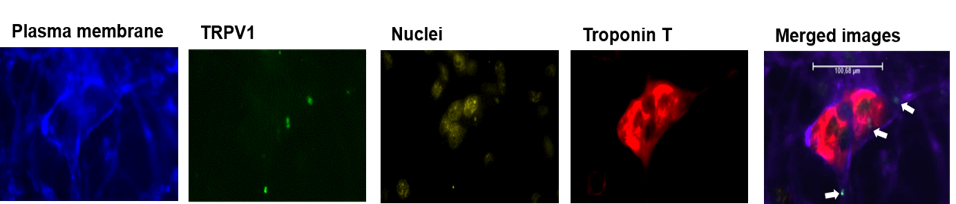
Wir wiesen die Expression von TRPV1 in der Plasmamembran von hiPSC-KMs (Troponin T-positive Zellen) nach (Abb. 3).
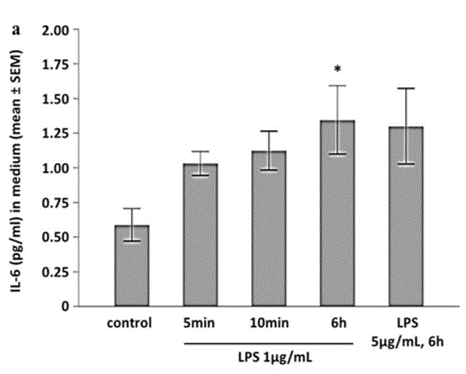
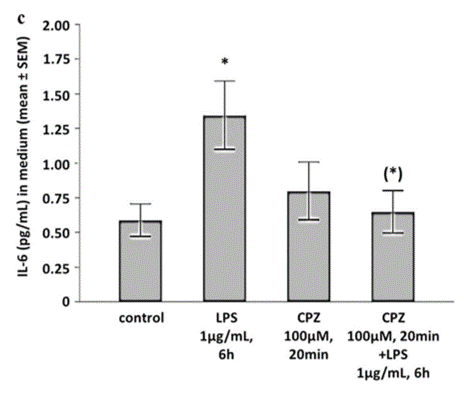
LPS steigerte die Sekretion des pro-inflammatorische Interleukins IL-6 (Abb. 4A). Dies wurde durch die Inkubation mit Capsaizin (CPZ), einem TRPV1-Antagonisten, verhindert (Abb. 4B).
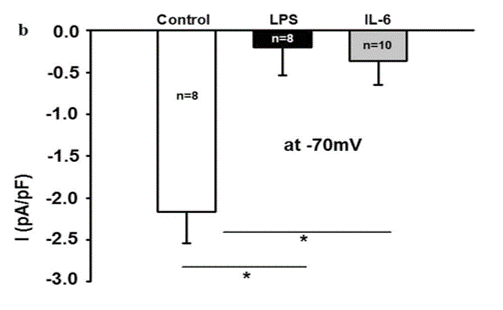
LPS führte zur Internalisierung von TRPV1 in die Zellen, gemessen an der korrigierten Zellfluoreszenz (CTCF; Abb. 5A), und zur Verminderung des TRPV1-vermittelten Kationen-Stroms (Abb. 5B).
Abbildungen 1-2 aus: Sattler et al., Sci Rep. 2019 Apr 4;9(1):5651. doi: 10.1038/s41598-019-42079-z. PMID: 30948775
Abbildungen 3-5 aus: Sattler et al., Sci Rep. 2021 Jul 19;11(1):14689. doi: 10.1038/s41598-021-93958-3. PMID: 34282193.
Mitarbeiter

Dr. med. Katherine Sattler
Oberärztin
Kardiale Devicetherapie

Univ.-Prof. Dr. med. Ibrahim Akin
Direktor und W3-Professur Sektion Invasive Kardiologie und Elektrophysiologie
Stellvertretender Direktor der I. Medizinischen Klinik
Leitung Kardiovaskuläre Forschung
Telefon 0621/383-2512

Tatjana Mierzwa
Leitende MTA
Publikationen
Sattler K, El-Battrawy I, Cyganek L, Lang S, Lan H, Li X, Zhao Z, Utikal J, Wieland T, Borggrefe M, Zhou X, Akin I. TRPV1 activation and internalization is part of the LPS-induced inflammation in human iPSC-derived cardiomyocytes.
Sci Rep. 2021 Jul 19;11(1):14689. doi: 10.1038/s41598-021-93958-3. PMID: 34282193.
Sattler K, El-Battrawy I, Zhao Z, Schrottenberg C, Yücel G, Lan H, Li X, Lang S, Zimmermann WH, Cyganek L, Utikal J, Wieland T, Ravens U, Bieback K, Borggrefe M, Zhou X, Akin I. Serum of patients with acute myocardial infarction prevents inflammation in iPSC-cardiomyocytes.
Sci Rep. 2019 Apr 4;9(1):5651. doi: 10.1038/s41598-019-42079-z. PMID: 30948775
Offene Stellen
We are currently accepting applications for MD-students and for Postdoctoral Fellows at Katherine.Sattler@umm.de. MD students can choose between thesis work in basic research (laboratory only), clinical-experimental work (patient based-experimental work), or projects involving patient care or clinical data survey (clinical work only).
Students will be trained in lab methods, animal care (if required), as well as in project design, data analysis, and presentation. They will be offered the chance to present data during in house-meetings and during scientific conferences, and will be supported in applications for grants or stipends. Depending on the project, part time- or full-time work for at least two years is expected.
Please provide with your application a C.V. and a summary of your previous scientific work and/or your scientific interest.
Kontakte
Prof. Dr. rer. nat. K. Bieback, Flow Core Unit, Medical Faculty Mannheim
Prof. Dr. rer. nat. G. Dobreva, Cardiovascular Genomics and Epigenomics, Medical Faculty Mannheim
Dr. rer. nat. L. Cyganek, Stem Cell Unit, Clinic for Cardiology and Pneumology, University Medical Center Göttingen
Dr. med. vet. S. Kirschner, Animal Core Unit, Medical Faculty Mannheim
Dr. med. vet. A. Mallien, Core Facility Tierlabor, ZI Mannheim
Dr. sc. hum. K. Mößinger, Core Facility Next Generation Sequencing, Medical Faculty Mannheim
Dr. F. Trogisch, Department of Cardiovascular Physiology, Medical Faculty Mannheim
Prof. Dr. ing. F. Zöllner, Computer Assisted Clinical Medicine, Medical Faculty Mannheim
