Sie befinden sich hier
Inhalt
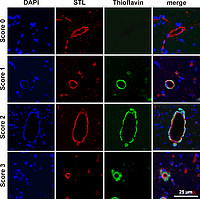
Repräsentative Darstellung und Klassifikation des Gefäßbefalls im CAA Mausmodell (Blau = Zellkerne). Solanum Tuberosum Lectin (STL) (rotes Signal) markiert alle Gefäße. Die mit Amyloid β befallenen Gefäße wurden mithilfe der Thioflavin-Färbung sichtbar gemacht (grün), so dass der prozentuale Anteil an befallenen Gefäßen erfasst werden kann. Entsprechend des Grades des Gefäßbefalls kann dieser klassifiziert werden.
Molekularbiologische Mechanismen und therapeutische Möglichkeiten der zerebralen Amyloidangiopathie
Die beiden häufigsten Ursachen von Demenz sind vaskuläre Erkrankungen des Gehirns (z.B. Schlaganfall) und Morbus Alzheimer. Zunehmend wird erkannt, dass diese Veränderungen nicht unabhängig voneinander, sondern parallel stattfinden.
Ein aktueller Forschungsschwerpunkt ist die mit vaskulärer Demenz und M. Alzheimer oftmals assoziierte Zerebrale Amyloidangiopathie (CAA), eine Erkrankung des Gefäßsystems.
Die Prävalenz der CAA beträgt in der älteren Bevölkerung nach pathologischen Studien 20–40% bei nicht an Demenz Erkrankten und 50–60% bei Patienten mit Demenz. Wie bei M. Alzheimer kommt es bei der CAA zu einer gehäuften Ablagerung des Proteins Amyloid β im Hirnparenchym oder innerhalb der Gefäßwand. Dies führt zu einer Einschränkung der Hirnfunktion sowie der Funktion hirnversorgender Gefäße.
Eine der wenigen Mausmodelle, die die Pathologien der CAA widerspiegeln, ist die transgene Maus vom Stamm APP23, welcher auch für unsere Erforschung der CAA verwendet wird. Die Mutation, welche die APP23 Maus trägt, führt zu einer stark vermehrten Ablagerung von Amyloid β, wobei sowohl die für M. Alzheimer typischen parenchymatösen Amyloid β-Plaques als auch ein erhöhter CAA typischer vaskulärer Befall zu beobachten ist. Dieser nimmt vergleichbar zur humanen Situation mit dem Alter zu.
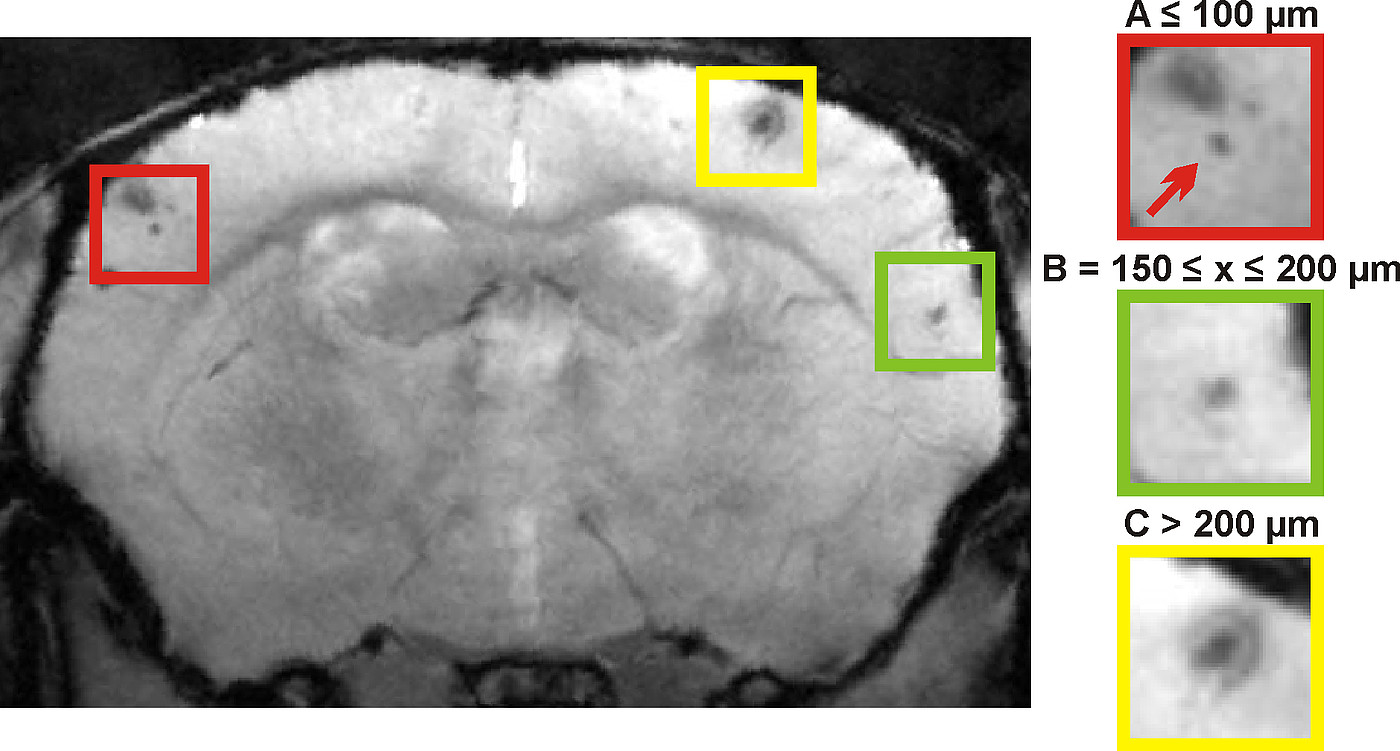
Die vaskulären Amyloid β-Ablagerungen haben eine Vielzahl an Mikroblutungen und ein erhöhtes Risiko für große parenchymatöse Blutungen zur Folge, deren Auftreten für die Erforschung der CAA unabdingbar sind. Obwohl schon in den 70er und 80er Jahren des vergangenen Jahrhunderts in histopathologischen Studien vermehrt die Rolle der CAA beschrieben wurde, erlebt diese in den letzten Jahren ein gesteigertes Interesse in der Forschung, u.a. auch aufgrund von verbesserten Bildgebungsverfahren, welche neben dem MRT auch die Positronen-Emissionstomographie (PET) einschließen. Mithilfe dieses Verfahrens wird es möglich sein, die Entwicklung des Amyloid β-Befalls nach therapeutischer Behandlung in vivo mithilfe von Radiotracern wie 18F-Flutemetanol zu verfolgen. Zukünftige Studien werden in Kooperation mit dem Institut für Klinische Radiologie und Nuklearmedizin (Lehrstuhl Prof. Dr. B. Wängler) durchgeführt werden.
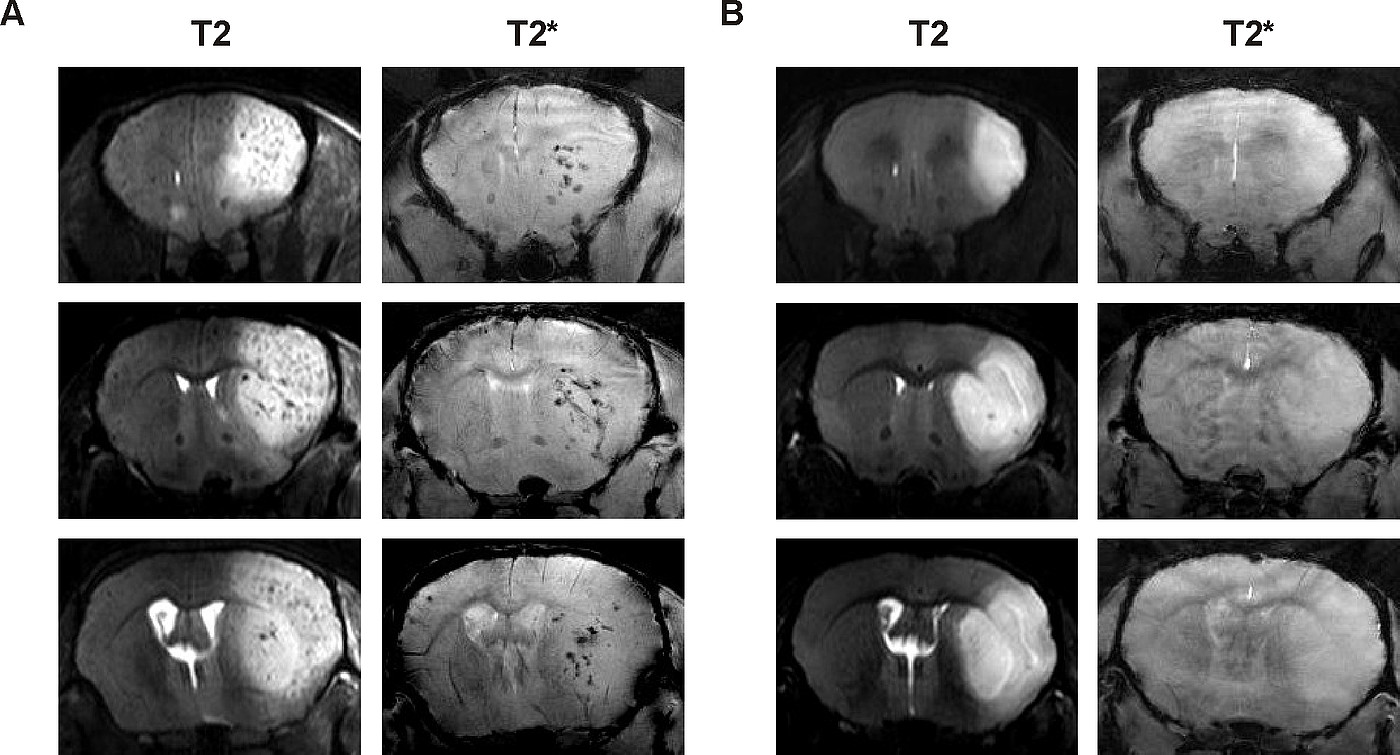
Vor allem bei CAA-Patienten mit krankheitsbedingtem erhöhtem Blutungsrisiko wird die rtPA-Lysetherapie mit ihren bekannten Nebenwirkungen bis jetzt nicht infrage gestellt. Ein weiterer Schwerpunkt unserer Forschung unter Zuhilfenahme des CAA-Mausmodells liegt daher in der besseren Einschätzung des Risikos für Blutungen nach Schlaganfall und Thrombolysetherapie. Erste Ergebnisse lassen hierbei vermuten dass der APP23-Genotyp mit einem erhöhten Risiko für Mikrobluutngen nach rtPA-Lysetherapie einhergeht, wodurch auch Rückschlüsse auf das Risiko von CAA-Patienten gezogen werden können.
Publikationen
- Development of Cerebral Microbleeds in the APP23-Transgenic Mouse Model of Cerebral Amyloid Angiopathy-A 9.4 Tesla MRI Study. Reuter B, Venus A, Heiler P, Schad L, Ebert A, Hennerici MG, Grudzenski S, Fatar M. Front Aging Neurosci. 2016 Jul 8;8:170. doi: 10.3389/fnagi.2016.00170. eCollection 2016. PMID: 27458375
- Statin Therapy and the Development of Cerebral Amyloid Angiopathy--A Rodent in Vivo Approach. Reuter B, Venus A, Grudzenski S, Heiler P, Schad L, Staufenbiel M, Hennerici MG, Fatar M. Int J Mol Sci. 2016 Jan 19;17(1):126. doi: 10.3390/ijms17010126. PMID: 26797603
- Thrombolysis in experimental cerebral amyloid angiopathy and the risk of secondary intracerebral hemorrhage. Reuter B, Grudzenski S, Chatzikonstantinou E, Meairs S, Ebert A, Heiler P, Schad LR, Staufenbiel M, Hennerici MG, Fatar M. Stroke. 2014 Aug;45(8):2411-6. doi: 10.1161/STROKEAHA.113.004483. Epub 2014 Jul 8. PubMed PMID: 25005438.
- Long term Statin Therapy and the Development of Cerebral Microbleeds in Cerebral Amyloid Angiopathy - A Rodent in vivo Approach. Venus A, Reuter B, Grudzenski S, Heiler P, Schad LR, Staufenbiel M, Hennerici MG, Fatar M. Presentation, XXII Europ. Stroke Conference 2013, London, GB
Kontextspalte
Ansprechpartnerin

Prof. Dr. med. Angelika Alonso
Geschäftsführende Oberärztin
